實時熒光定量PCR
一個極有效的實驗方法
實時熒光定量PCR (Quantitative Real-time PCR)是一種在DNA擴增反應中,以熒光化學物質測每次聚合酶鏈式反應(PCR)循環后產物總量的方法。通過內參或者外參法對待測樣品中的特定DNA序列進行定量分析的方法。
Real-timePCR是在PCR擴增過程中,通過熒光信號,對PCR進程進行實時檢測。由於在PCR擴增的指數時期,模板的Ct值和該模板的起始拷貝數存在線性關係,所以成為定量的依據。
所謂實時熒光定量PCR技術,是指在PCR反應體系中加入熒光基團,利用熒光信號積累實時監測整個PCR進程,最後通過標準曲線對未知模板進行定量分析的方法。
檢測方法
1.SYBRGreenⅠ法:
在PCR反應體系中,加入過量SYBR熒光染料,SYBR熒光染料特異性地摻入DNA雙鏈后,發射熒光信號,而不摻入鏈中的SYBR染料分子不會發射任何熒光信號,從而保證熒光信號的增加與PCR產物的增加完全同步。

實時熒光定量PCR
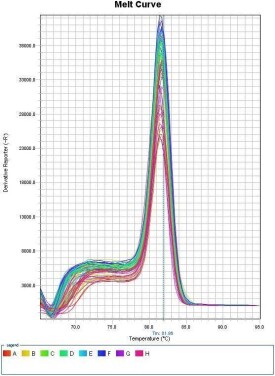
SYBR定量PCR擴增熒光曲線圖
PCR產物熔解曲線圖(單一峰圖表明PCR擴增產物的單一性)
2.TaqMan探針法:
探針完整時,報告基團發射的熒光信號被淬滅基團吸收;PCR擴增時,Taq酶的5’-3’外切酶活性將探針酶切降解,使報告熒光基團和淬滅熒光基團分離,從而熒光監測系統可接收到熒光信號,即每擴增一條DNA鏈,就有一個熒光分子形成,實現了熒光信號的累積與PCR產物的形成完全同步。
技術原理
將標記有熒光素的Taqman探針與模板DNA混合后,完成高溫變性,低溫復性,適溫延伸的熱循環,並遵守聚合酶鏈反應規律,與模板DNA互補配對的Taqman探針被切斷,熒光素遊離於反應體系中,在特定光激發下發出熒光,隨著循環次數的增加,被擴增的目的基因片段呈指數規律增長,通過實時檢測與之對應的隨擴增而變化熒光信號強度,求得Ct值,同時利用數個已知模板濃度的標準品作對照,即可得出待測標本目的基因的拷貝數。
Ct值(Cycle threshold,循環閾值)的含義為:每個反應管內的熒光信號到達設定閾值時所經歷的循環數。
1. 熒光閾值(threshold)的設定
PCR反應的前15個循環的熒光信號作為熒光本底信號,熒光閾值的預設(默認)設置是3-15個循環的熒光信號的標準偏差的10倍,即:threshold = 10*SDcycle 3-15
2. Ct值與起始模板的關係
每個模板的Ct值與該模板的起始拷貝數的對數存在線性關係,公式如下。
Ct=-1/lg(1+Ex)*lgX0+lgN/lg(1+Ex)
n為擴增反應的循環次數,X0為初始模板量,Ex為擴增效率,N為熒光擴增信號達到閾值強度時擴增產物的量。
起始拷貝數越多,Ct值越小。利用已知起始拷貝數的標準品可作出標準曲線,其中橫坐標代表起始拷貝數的對數,縱坐標代Ct值。因此,只要獲得未知樣品的Ct值,即可從標準曲線上計算出該樣品的起始拷貝數。
熒光化學物質
實時熒光定量PCR所使用的熒光物質可分為兩種:熒光探針和熒光染料。現將其原理簡述如下:
1. TaqMan熒光探針:PCR擴增時在加入一對引物的同時加入一個特異性的熒光探針,該探針為一寡核苷酸,兩端分別標記一個報告熒光基團和一個淬滅熒光基團。探針完整時,報告基團發射的熒光信號被淬滅基團吸收;PCR擴增時,Taq酶的5'-3'外切酶活性將探針酶切降解,實現了熒光信號的累積與PCR產物形成完全同步。而新型TaqMan-MGB探針使該技術既可進行基因定量分析,又可分析基因突變(SNP),有望成為基因診斷和個體化用藥分析的首選技術平台。
3. 分子信標:是一種在5和3末端自身形成一個8個鹼基左右的髮夾結構的莖環雙標記寡核苷酸探針,兩端的核酸序列互補配對,導致熒光基團與淬滅基團緊緊靠近,不會產生熒光。PCR產物生成后,退火過程中,分子信標中間部分與特定DNA序列配對,熒光基因與淬滅基因分離產生熒光 。
傳統定量PCR
1.傳統定量PCR方法簡介
(1)內參照法:在不同的PCR反應管中加入已定量的內標和引物,內標用基因工程方法合成。上游引物用熒游標記,下游引物不用標記。在模板擴增的同時,內標也被擴增。在PCR產物中,由於內標與靶模板的長度不同,二者的擴增產物可用電泳或高效液相分離開來,分別測定其熒光強度,以內標為對照定量待檢測模板。
(2)競爭法:選擇由突變克隆產生的含有一個新內切位點的外源競爭性模板。在同一反應管中,待測樣品與競爭模板用同一對引物同時擴增(其中一個引物為熒游標記)。擴增後用內切酶消化PCR產物,競爭性模板的產物被酶解為兩個片段,而待測模板不被酶切,可通過電泳或高效液相將兩種產物分開,分別測定熒光強度,根據已知模板推測未知模板的起始拷貝數。
(3)PCR-ELISA法:利用地高辛或生物素等標記引物,擴增產物被固相板上特異的探針所結合,再加入抗地高辛或生物素酶標抗體-辣根過氧化物酶結合物,最終酶使底物顯色。常規的PCR-ELISA法只是定性實驗,若加入內標,作出標準曲線,也可實現定量檢測目的。
2.內標在傳統定量中的作用
由於傳統定量方法都是終點檢測,即PCR到達平台期後進行檢測,而PCR經過對數期擴增到達平台期時,檢測重現性極差。同一個模板在96孔PCR儀上做96次重複實驗,所得結果有很大差異,因此無法直接從終點產物量推算出起始模板量。加入內標后,可部分消除終產物定量所造成的不準確性。但即使如此,傳統的定量方法也都只能算作半定量、粗略定量的方法。
3.內標對定量PCR的影響
若在待測樣品中加入已知起始拷貝數的內標,則PCR反應變為雙重PCR,雙重PCR反應中存在兩種模板之間的干擾和競爭,尤其當兩種模板的起始拷貝數相差比較大時,這種競爭會表現得更為顯著。但由於待測樣品的起始拷貝數是未知的,所以無法加入合適數量的已知模板作為內標。也正是這個原因,傳統定量方法雖然加入內標,但仍然只是一種半定量的方法。
實時熒光定量PCR
實時熒光定量PCR技術有效地解決了傳統定智能能終點檢測的局限,實現了每一輪循環均檢測一次熒光信號的強度,並記錄在電腦軟體之中,通過對每個樣品Ct值的計算,根據標準曲線獲得定量結果。因此,實時熒光定量PCR無需內標是建立在兩個基礎之上的:
(1)Ct值的重現性PCR循環在到達Ct值所在的循環數時,剛剛進入真正的指數擴增期(對數期),此時微小誤差尚未放大,因此Ct值的重現性極好,即同一模板不同時間擴增或同一時間不同管內擴增,得到的Ct值是恆定的。
(2)Ct值與起始模板的線性關係由於Ct值與起始模板的對數存在線性關係,可利用標準曲線對未知樣品進行定量測定,因此,實時熒光定量PCR是一種採用外標準曲線定量的方法。
外標準曲線的定量方法相比內標法是一種準確的、值得信賴的科學方法。利用外標準曲線的實時熒光定量PCR是迄今為止定量最準確,重現性最好的定量方法,已得到全世界的公認,廣泛用於基因表達研究、轉基因研究,藥物療效考核、病原體檢測等諸多領域。
實時熒光定量PCR的定量方法
在Real-timePCR中,模板定量有兩種策略,相對定量和絕對定量。
臨床疾病診斷
各型肝炎、艾滋病、禽流感、結核、性病等傳染病診斷和療效評價;地中海貧血、血友病、性別發育異常、智力低下綜合症、胎兒畸形等優生優育檢測;腫瘤標誌物及瘤基因檢測實現腫瘤病診斷;遺傳基因檢測實現遺傳病診斷。
動物疾病檢測
食品安全
科學研究
醫學、農牧、生物相關分子生物學定量研究。
應用行業
根據MIQE(Minimum Information for Publication of Quantitative Real-Time PCR Experiments) 的指導方針,qPCR為Quantitative real-time PCR的簡稱,RT-qPCR指的是Reverse transcription–qPCR,RT-PCR僅用來表示Reverse transcription polymerase chain reaction,而不是Real-time PCR,但是有少數作者並沒有堅持這一原則。
2013年春季,中國內地發生多起H7N9禽流感染人人類事件,截至4月6日下午五時,全國共報告18例人類感染,6人死亡。針對此次禽流感事件,對送檢樣本進行H7N9檢測的方法共有兩種,一種是進行核酸檢測,即採用實時熒光定量PCR方法對H7N9的特異性核酸進行檢測;另一種一種就是對樣本進行H7N9病毒分離鑒定,直接獲取毒株。“核酸檢測快速準確,是現在實驗室採用的主要檢驗方法。”專家說,H7N9特異性核酸檢驗耗時短,從完成樣本處理到最後獲取檢測結果,進行確診,整個過程在3-5個小時內完成,可實現對病毒的快速診斷。
檢測過程分為三個步驟:對醫院採集樣本進行標本處理,如果發現可疑病例,將由當地醫院專業的醫護人員進行採樣,主要提取患者的咽拭子樣本或含漱液、鼻拭子、肺部清洗液的樣本,安全保存後送至實驗室開展病毒檢測;提取病毒核酸,隨後與H7N9核酸檢測試劑配成反應體系,因為檢測試劑主要針對H7N9的特異性核酸片段會起反應。可以說,通過這個試劑能快速確定病人是否感染了H7N9禽流感病毒;放入熒光定量PCR儀做病毒核酸特異擴增,進行熒光定量檢測,最後結果進行檢測分析,判斷是否呈陽性反應。
浙江省公共衛生檢驗檢測重點學科群首席專家、應急監測關鍵技術重點實驗室主任盧亦愚教授,介紹了浙江省自行合成H7N9禽流感檢測試劑:
“H7N9禽流感檢測試劑被放置在食指大小的密封透明試管里。每套檢測試劑由6份EP管組成,包含白色的水滴形小管‘引物’,以及棕色小管‘探針’。引物和探針主要是針對H7N9特異性核酸片段。目前這些試劑被放在專用試劑盒中,放置在專用冰箱保存。”