細胞衰老
細胞衰老
細胞衰老(cell aging)是指細胞在執行生命活動過程中,隨著時間的推移,細胞增殖與分化能力和生理功能逐漸發生衰退的變化過程。細胞的生命歷程都要經過未分化、分化、生長、成熟、衰老和死亡幾個階段。衰老死亡的細胞被機體的免疫系統清除,同時新生的細胞也不斷從相應的組織器官生成,以彌補衰老死亡的細胞。細胞衰老死亡與新生細胞生長的動態平衡時維持機體正常生命活動的基礎。
細胞是生物體結構和功能的基本單位,也是生物體衰老基本單位。細胞衰老在形態學上表現為細胞結構的退行性變,如在細胞核,核膜凹陷,最終導致核膜崩解,染色質結構變化,超二倍體和異常多倍體的細胞數目增加;細胞膜脆性增加選擇性通透能力下降,膜受體種類、數目和對配體的敏感性等發生變化;脂褐素在細胞內堆積,多種細胞器和細胞內結構發生退行性變。細胞衰老在生理學上的表現為功能衰退與代謝低下,如細胞周期停滯,細胞複製能力喪失,對促有絲分裂刺激的反應性減弱,對促凋亡因素的反應性改變;細胞內酶活性中心被氧化,酶活性降低,蛋白質合成下降等。
氧自由基學說認為細胞衰老是機體代謝產生的氧自由基對細胞損傷的積累。端粒學說提出細胞染色體端粒縮短的衰老生物鐘理論,認為細胞染色體末端特殊結構-端粒的長度決定了細胞的壽命。DNA損傷衰老學說認為細胞衰老是DNA損傷的積累。基因衰老學說認為細胞衰老受衰老相關基因的調控。分子交聯學說則認為生物大分子之間形成交聯導致細胞衰老,也有學者認為,脂褐素蓄積、糖基化反應以及細胞在蛋白質合成中難免發生的誤差等因素導致細胞衰老。
細胞衰老和機體衰老是兩個不同的概念,但兩者有密切關係。機體衰老的基礎是構成機體的細胞在整體、系統或器官水平的衰老,但不等於構成機體的所有細胞都發生了衰老。正常生命活動中細胞衰老死亡與新生細胞生長更替是新陳代謝的必然規律,也避免了組織結構退化和衰老細胞的堆積,使機體延緩了整體衰老。不同種類的細胞其壽命和更新時間有很大的差別,如成熟粒細胞的壽命僅為10餘小時,紅細胞壽命約為4個月,胃腸道的上皮細胞每周需要更新1次,胰腺上皮細胞的更新約需要50天,而皮膚表皮細胞的更新則大約需要1~2個月。由此可見細胞的壽命總是比人的壽命短很多。發育生物學理論認為,哺乳動物自然壽命約為其生長發育期的5~7倍。由此推論,人類完成生長發育約在20~22周歲,自然壽命應是100~150歲,但事實上大多數人都很難達到這個理論壽命。細胞衰老是機體衰老和死亡的基礎。雖然,自然衰老不是疾病,但它與許多老年性疾病關係緊密。隨著年齡增長,衰老機體在應激和損傷狀態下,保持和恢復體內穩態的能力下降,因此罹患心血管疾病、惡性腫瘤、糖尿病、自身免疫疾病和老年性痴獃等幾率增大。人們往往把老年性疾病認為是衰老的必然結果,這是不夠準確的,應該強調生理學衰老與病理性衰老有本質區別。生理性衰老是一個緩慢過程,生理性衰老者基本上能夠老而無疾,老而不衰,甚至老當益壯。病理性衰老是指常年身體虛弱,疾病纏身,疾病促使機體加速老化。然而,當前人們對衰老生物學機制的認識尚淺,無論是生理性衰老,還是病理性衰老都是以機體細胞總體水平的衰老為基礎,要闡明機體衰老的機制必須從研究細胞衰老的機制開始。儘管衰老死亡是不可避免的自然規律,但延緩衰老,尤其是努力避免病理性衰老卻是可以做到的。據報道,2050年全球60歲以上老年人達到20億,大約為總人口的20~30%。面臨人口老化進程加快和人口壽命普遍提高的趨勢,保障老年人享有良好的健康和較高的生活質量已成為社會科學和生命科學共同關注的重大問題。因此,開展衰老生物學和延緩衰老的研究具有重要的科學意義和社會價值。
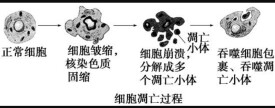
研究表明,衰老細胞的細胞核、細胞質和細胞膜等均有明顯的變化:
①細胞內水分減少,體積變小,新陳代謝速度減慢;
②細胞內大多數酶的活性降低;
③細胞內的色素會積累;
④細胞內呼吸速度減慢,細胞核體積增大,核膜內折,染色質收縮,顏色加深。線粒體數量減少,體積增大;
⑤細胞膜通透性功能改變,使物質運輸功能降低。
總體來說老化細胞的各種結構呈退行性變化。衰老細胞的形態變化表現有:
1、核:增大、染色深、核內有包含物
2、染色質:凝聚、固縮、碎裂、溶解
3、質膜:粘度增加、流動性降低
4、細胞質:色素積聚、空泡形成
5、線粒體:數目減少、體積增大
6、高爾基體:碎裂
7、尼氏體:消失
8、包含物:糖原減少、脂肪積聚
9、核膜:內陷
認為衰老是遺傳決定的自然演進過程,一切細胞均有內在的預定程序決定其壽命,而細胞壽命又決定種屬壽命的差異,而外部因素只能使細胞壽命在限定範圍內變動。
有以下三種學說
細胞有限分裂學說
L.Hayflick (1961)報道,人的纖維細胞在體外培養時增殖次數是有限的。後來許多實驗證明,正常的動物細胞無論是在體內生長還是在體外培養,其分裂次數總存在一個“極極值”。此值被稱為“Hayflick”極限,亦稱最大分裂次數。如人胚成纖維細胞在體外培養時只能增殖60~70代。
普遍認為細胞增殖次數與端粒DNA長度有關。
Harley等1991發現體細胞染色體的端粒DNA會隨細胞分裂次數增加而不斷縮短。DNA複製一次端粒就縮短一段,當縮短到一定程度至Hayflick點時,細胞停止複製,而走向衰亡。資料表明人的成纖維細胞端粒每年縮短14~18bp,可見染色體的端粒有細胞分裂計數器的功能,能記憶細胞分裂的次數。
重複基因失活學說
真核生物基因組DNA重複序列不僅增加基因信息量,而且也是使基因信息免遭機遇性分子損害的一種方式。主要基因的選擇性重複是基因組的保護性機制,也可能是決定細胞衰老速度的一個因素,重複基因的一個拷貝受損或選擇關閉后,其它拷貝被激活,直到最後一份拷貝用完,細胞因缺少某種重要產物而衰亡。實驗證明小鼠肝細胞重複基因的轉錄靈敏度隨年齡而逐漸降低。哺乳動物rRNA基因數隨年齡而減少。
衰老基因學說
統計學資料表明,子女的壽命與雙親的壽命有關,各種動物都有相當恆定的平均壽命和最高壽命,成人早衰症病人平均39歲時出現衰老,47歲生命結束,嬰幼兒早衰症的小孩在1歲時出現明顯的衰老,12~18歲即過早夭折。由此來看物種的壽命主要取決於遺傳物質,DNA鏈上可能存在一些“長壽基因”或“衰老基因”來決定個體的壽限。
用線蟲的研究表明,基因確可影響衰老及壽限,Caenrhabditis elegans的平均壽命僅3.5天,該蟲age-1 單基因突變,可提高平均壽命65%,提高最大壽命110%,age-1突變型有較強的抗氧化酶活性,對H2O2、農藥、紫外線和高溫的耐受性均高於野生型。
對早衰老綜合症的研究發現體內解旋酶存在突變,該酶基因位於8號染色體短臂,稱為WRN基因,對AD的研究發現,至少與4個基因的突變有關。其中澱粉樣蛋白前體基因(APP)的突變,導致基因產物β澱粉蛋白易於在腦組織中沉積,引起基因突變。
細胞衰老是各種細胞成分在受到內外環境的損傷作用后,因缺乏完善的修復,使“差錯”積累,導致細胞衰老。根據對導致“差錯”的主要因子和主導因子的認識不同,可分為不同的學說,這些學說各有實驗證據。
有以下七種學說
代謝廢物積累學說
細胞代謝產物積累至一定量後會危害細胞,引起衰老,哺乳動物脂褐質的沉積是一個典型的例子,脂褐質是一些長壽命的蛋白質和DNA、脂類共價縮合形成的巨交聯物,次級溶酶體是形成脂褐質的場所,由於脂褐質結構緻密,不能被徹底水解,又不能排出細胞,結果在細胞內沉積增多,阻礙細胞的物質交流和信號傳遞。最後導致細胞衰老。研究還發現老年性痴獃(AD)腦內的脂褐質、腦血管沉積物中有β-澱粉樣蛋白,因此β-AP可做為AD的鑒定指標。
大分子交聯學說
過量的大分子交聯是衰老的一個主要因素,如DNA交聯和膠原膠聯均可損害其功能,引起衰老。在臨床方面膠原交聯和動脈硬化、微血管病變有密切關係。
自由基是一類瞬時形成的含不成對電子的原子或功能基團,普遍存在於生物系統。其種類多、數量大,是活性極高的過渡態中間產物。如O2ˉ··、OH·和各類活性氧中間產物(reactive oxygen metabolite ROM),正常細胞內存在清除自由基的防禦系統,包括酶系統和非酶系統。前者如:超氧化物歧化酶(SOD),過氧化氫酶(CAT),谷胱甘肽過氧化物酶(GSH-PX),非酶系統有維生素E,醌類物質等電子受體。
機體通過生物氧化反應為組織細胞生命活動提供能量,同時在此過程中也會產生大量活性自由基。自由基的化學性質活潑,可攻擊生物體內的DNA、蛋白質和脂類等大分子物質,造成損傷,如DNA的斷裂、交聯、鹼基羥基化。蛋白質的變性而失活,膜脂中不飽和脂肪酸的氧化而流動性降低。實驗表明DNA中OH8dG隨著年齡的增加而增加。OH8dG完全失去鹼基配對特異性,不僅OH8dG被錯讀,與之相鄰的胞嘧啶也被錯誤複製。
大量實驗證明實,超氧化物岐化酶與抗氧化酶的活性升高能延緩機體的衰老。Sohal等人(1994、1995),將超氧化物岐化酶與過氧化氫酶基因導入果蠅,使轉基因株比野生型這兩種酶基因多一個拷貝,結果轉基因株中酶活性顯著升高,平均年齡和最高壽限有所延長。
DNA損傷修復學說
外源的理化因子,內源的自由基本均可導致DNA的損傷。正常機體內存在DNA的修復機制,可使損傷的DNA得到修復,但是隨著年齡的增加,這種修復能力下降,導致DNA的錯誤累積,最終細胞衰老死亡。DNA的修復並不均一,轉錄活躍基因被優先修復,而在同一基因中轉錄區被優先修復,而徹底的修復僅發生在細胞分裂的DNA複製時期,這就是幹細胞能永保青春的原因。
端粒學說
染色體兩端有端粒,細胞分裂次數多,端粒向內延伸,正常DNA受損。
生物分子自然交聯說
該學說在論證生物體衰老的分子機制時指出:生物體是一個不穩定的化學體系,屬於耗散結構。體系中各種生物分子具有大量的活潑基團,它們必然相互作用發生化學反應使生物分子緩慢交聯以趨向化學活性的穩定。隨著時間的推移,交聯程度不斷增加,生物分子的活潑基團不斷消耗減少,原有的分子結構逐漸改變,這些變化的積累會使生物組織逐漸出現衰老現象。生物分子或基因的這些變化一方面會表現出不同活性甚至作用徹底改變的基因產物,另一方面還會幹擾RNA聚合酶的識別結合,從而影響轉錄活性,表現出基因的轉錄活性有次序地逐漸喪失,促使細胞、組織發生進行性和規律性的表型變化乃至衰老死亡。
生物分子自然交聯說論證生物衰老的分子機制的基本論點可歸納如下:其一,各種生物分子不是一成不變的,而是隨著時間推移按一定自然模式發生進行性自然交聯。其二,進行性自然交聯使生物分子緩慢聯結,分子間鍵能不斷增加,逐漸高分子化,溶解度和膨潤能力逐漸降低和喪失,其表型特徵是細胞和組織出現老態。其三,進行性自然交聯導致基因的有序失活,使細胞按特定模式生長分化,使生物體表現出程序化和模式化生長、發育、衰老以至死亡的動態變化歷程。