心臟擴張
心臟擴張
擴張型心肌病(dilated cardiomyopathy,DCM)的特點是以左心室(多數)或右心室有明顯擴大,且均伴有不同程度的心肌肥厚,心室收縮功能減退,以心臟擴大、心力衰竭、心律失常、栓塞為基本特徵。以往曾被稱為充血性心肌病。本病常伴有心律失常,病死率較高。約20%的DCM患者有心肌病的家族史。起病緩慢,任何年齡均可發病,以30~50歲多見,部分患者有原發性高血壓史。
擴張型心肌病的診斷率逐漸增加,據估計,年診斷率約為8/10萬,患病率約為37/10萬,其中半數患者年齡在55歲以下,約1/3患者心功能為Ⅲ~Ⅳ級(紐約心臟病協會分級標準)。但部分未被診斷的輕型患者可能會使實際患病率更高。
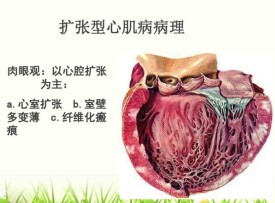
肉眼觀,心臟體積增大,重量增加,常超出正常人20%~50%以上,重量可達400g~750g以上。兩側心室肥大,四個心腔擴張,心尖部變薄呈鈍圓形,因心腔擴張可致二尖瓣和三尖瓣相對性關閉不全。心內膜增厚,可見附壁性血栓。
鏡下,部分心肌細胞肥大、伸長,核大濃染,可見畸形核。心內膜下及心肌間質纖維化,見有小瘢痕,病變以左室為重,肉柱間隱窩可見附壁血栓。有時可見部分心肌細胞變性。
本病起病緩慢,任何年齡均可發病,以30~50歲多見,部分患者有原發性高血壓史。主要表現如下:
1.癥狀
(1)充血性心力衰竭:為本病最突出的表現。其發生主要是由於心室收縮力下降、順應性降低和體液瀦留導致心排出量不足及(或)心室充盈壓過度增高所致。可出現左心功能不全的癥狀,常見的為進行性乏力或進行性勞動耐力下降、勞力性呼吸困難、端坐呼吸以及陣發性夜間呼吸困難等左心衰的表現,病變晚期可同時出現右心衰的癥狀:如肝臟大、上腹部不適以及周圍性水腫。
(2)心律失常:可發生各種快速或緩慢型心律失常,甚至為本病首發臨床表現;嚴重心律失常是導致該病猝死的常見原因。
2.體征
(1)心尖搏動常明顯向左側移位,但左室明顯向後增大時可不出現;心尖搏動常彌散;深吸氣時在劍突下或胸骨左緣可觸到右心室搏動。
(3)心功能失代償時會出現明顯的二尖瓣反流性雜音。該雜音在腋下最清楚,在心功能改善後常可減輕,有時可與胸骨旁的三尖瓣反流性雜音相重疊,但後者一般在心衰晚期出現。
(4)心衰明顯時可出現交替脈和潮式呼吸。肺動脈壓顯著增高的患者,可於舒張早期聽到短暫、中調的肺動脈反流性雜音。
擴張型心肌病是多種因素長期作用引起心肌損害的最終結果(DCM的主要病因見表1)。
感染或非感染性心肌炎、酒精中毒、代謝等多種因素均可能與擴張型心肌病發病有關。短暫的原發性心肌損傷(如接觸毒性物質)對某些心肌細胞來說可能是致死性的,但殘存的心肌細胞會因此而增加負荷,發生代償性肥厚。這種代償性變化在早期尚能維持心臟的整體功能,但最終將表現為心肌的收縮和舒張功能障礙。心肌炎既有不可逆的心肌細胞死亡,又有由細胞因子所介導的可逆性心肌抑制。某些因素(如酒精)雖然不直接損害心肌細胞,但如長期作用仍可造成嚴重的心臟功能障礙。此外,許多損傷還會累及心臟的纖維支架系統,影響心肌的順應性,從而參與心室擴大的發生與發展。
1.發病機制研究表明,多數擴張型心肌病與病毒感染及自身免疫反應有關。業已發現,病毒性心肌炎可以演變為擴張型心肌病,在心肌炎和擴張型心肌病病人心內膜心肌活檢標本中均可發現腸道病毒基因,擴張型心肌病患者血清可檢測出多種抗心肌的自身抗體,如抗ADP/ATP載體抗體、抗β1腎上腺素能受體抗體、抗M2膽鹼能受體抗體和抗肌球蛋白重鏈抗體等,也可以檢測出腸道病毒基因片段。病毒感染和免疫反應損傷學說是目前擴張型心肌病主要的發病學說。此外,遺傳因素也可能起一定作用。
(1)病毒持續感染:病毒感染后體內持續存在的病毒RNA是病毒性心肌炎進展為擴張型心肌病的一個危險因素。小鼠動物試驗顯示,柯薩奇病毒能溶解心肌細胞,腸道病毒蛋白酶可以引起心肌細胞骨架破壞,而這種改變被公認為是擴張型心肌病的主要特徵。病毒對心肌細胞的損害既可發生在病毒滴度較高的時期(柯薩奇B1、B4病毒感染病例),也可發生於病毒(柯薩奇B3病毒)感染后免疫反應開始時。病毒對心肌組織的損傷既可直接損傷,亦可通過免疫機製造成損傷。當病毒RNA持續存在於心肌時,T淋巴細胞可浸潤心肌組織。研究表明,病毒基因的低水平表達可引起慢性進行性心肌損傷,當病毒RNA在心肌持續存在90天以上時,心肌可呈現類似擴張型心肌病的病理變化。當機體防禦能力降低時,機體可呈慢性病毒攜帶狀態。在此慢性過程中,病毒可存在於脾臟、肝臟、胰腺和全身淋巴結。其危害不在於對心肌的直接侵襲,而在於激發機體的免疫反應;同時持續存在的病毒RNA仍可複製,產生無侵襲性但具有抗原性的大量病毒RNA,誘發機體的免疫反應,引起心肌損傷。
(2)自身免疫反應:目前推測免疫介導的心肌損害是DCM發病的重要機制。
①體液免疫:在擴張型心肌病患者血清標本中可檢測出多種抗心肌的自身抗體,包括抗線粒體ADP/ATP載體抗體、抗β1-腎上腺素能受體抗體、抗M2膽鹼能受體抗體、抗熱休克蛋白抗體、抗肌球蛋白重鏈抗體、抗支鏈α-酮酸脫氫酶(branchedchainalphaketoaciddehydrogenase,BCKD)複合體抗體和抗層粘連蛋白(laminin)抗體等,這些自身抗體在本病發病中起重要作用。
A.抗線粒體ADP/ATP載體(ANT)抗體:研究發現,ANT與病原體蛋白存在共同的抗原決定簇,如ANT氨基酸序列27~36和柯薩奇B3病毒精氨酸序列1218~1228相似,可通過交叉反應引起自身抗體產生。也有研究認為,病毒感染導致線粒體隔離抗原釋放,或引起心肌抗原性質改變,或通過旁路激活自身反應性T淋巴細胞,從而誘髮針對線粒體的自身免疫反應。抗ANT抗體能抑制心肌線粒體的ATP/ADP轉運,導致心肌細胞能量代謝障礙,損害心肌功能。ANT與鈣通道蛋白亦可能有相同的抗原決定簇。抗ANT抗體可與心肌細胞膜上的鈣通道蛋白結合,抑制鈣通道失活,促進鈣內流,使細胞內鈣超負荷,導致心肌細胞變性壞死。換言之,抗ANT抗體激活Ica引起的鈣超負荷是DCM患者心肌損傷的原因之一。
B.抗β1-受體抗體:β-受體屬G蛋白耦聯膜受體,當β-受體與神經體液遞質結合后被激活,在產生生理效應的同時,受體內陷,與溶酶體融和,蛋白分解酶使其降解。溶酶體可與表面含有主要組織相容性複合體(MHC)類分子的核受體結合,如果降解后產生的受體多肽能與MHC分子形成複合體,該複合體可被轉運到膜表面,遞呈給輔助T淋巴細胞(TH)受體,激活TH。活化的TH與B淋巴細胞相互作用,產生針對自身受體多肽分子的特異性抗體。正常情況下,心肌細胞不表達MHC類分子,只有當其具備免疫活性時才表達MHC類分子。病毒感染可誘導心肌細胞表達MHC類分子,使心肌細胞成為抗原提呈細胞。另外,病毒與β受體分子結構上具有的共同抗原決定簇,可通過模擬機制引起抗β受體抗體產生。抗β1受體抗體能激活受體的Ca2+通道,增加心肌細胞Ca2+內流,導致鈣超負荷,引起心肌細胞損傷。同時,抗β1受體抗體可增加心肌細胞cAMP依賴的蛋白激酶(PK)活性,通過與β受體結合使細胞質與質粒PK活性之比明顯提高,導致細胞質和質粒cAMP依賴的PK激活,實現正性變時變性作用。也有作者認為,抗β1-受體抗體可影響心肌細胞信息傳遞,使受體調節的心肌細胞代謝發生紊亂,心肌細胞β-受體數目下調,誘發心肌損害。
C.抗肌球蛋白抗體:目前認為有兩種機制引起擴張型心肌病患者發生免疫應答,產生抗肌球蛋白抗體:
a.病毒感染或引起心肌組織壞死的其他原因導致肌球蛋白的釋放和暴露,觸發機體的自身免疫;
b.病毒分子與肌球蛋白有相似的抗原決定簇。
D.抗M2膽鹼能受體抗體:M2膽鹼能受體是位於心肌細胞膜上的一種蛋白質,屬G蛋白耦聯膜受體,與β受體一起協同調節心肌腺苷酸環化酶的活性和離子通道,調節心臟功能。而抗M2膽鹼能受體抗體具有擬膽鹼能樣作用,能減低豚鼠心室肌由異丙腎上腺素引起的環磷酸腺苷(cAMP)濃度的增加,減慢心室肌細胞的收縮頻率,減慢心室壓力增加的最大速度,減慢心率。這種由抗M2膽鹼能受體抗體引起的抑制作用可由膽鹼能拮抗劑阿托品或用中和抗體抵消。該抗體的產生可能是由於病毒感染后使M2膽鹼能受體成為自身抗原,激發自身免疫反應所致。
E.其他抗體:除以上幾種抗心肌自身抗體外,在擴張型心肌病患者血清中還存在抗線粒體M7抗體、抗BCKD複合體抗體、抗肌動蛋白抗體、抗肌漿網ATP酶抗體等。儘管大約30%~40%的擴張型心肌病病人血清中有器官和疾病特異性自身抗體,但仍有部分病人不出現抗自身抗體,這可能與以下幾種因素有關:
a.擴張型心肌病是一種多因素疾病,缺乏自身抗體說明以細胞免疫引起損害為主或由其他因素引起;
b.心臟的自身抗體可能是疾病的早期徵象,隨著病程的延長會消失;
c.不同的擴張型心肌病病人可出現不同的自身抗體,因檢測方法和檢測種類不同,可產生陰性結果;
d.自身抗體的產生與人類白細胞抗原有關。
②細胞免疫:在擴張型心肌病中,細胞介導的異常免疫反應表現為損害淋巴細胞功能、改變淋巴細胞亞群的比例和活化免疫細胞因子系統。擴張型心肌病病人外周血總T細胞(CD3)、抑制性/細胞毒性T細胞(CD8)明顯降低,輔助性/誘導性T細胞(CD4)無明顯變化。研究表明,細胞毒性T淋巴細胞有體外溶解病毒感染的心肌細胞的作用。病毒感染后,心肌細胞膜上可呈現一種稱為T細胞受體的多肽,T淋巴細胞識別並和這種受體結合后,可引起心肌細胞損傷;應用抗T細胞受體抗體可使心肌細胞損傷減輕。此外,自然殺傷細胞尚可分泌一種穿孔素(perforin),使心肌細胞形成孔狀損傷。
③細胞因子的作用:DCM患者血清中炎症因子水平顯著增高,腫瘤壞死因子(TNF)α/白細胞介素(IL)-10比值與血漿腎上腺素水平呈正相關;血清TNF受體(sTNFR)水平與左心室大小相關;白介素含量與心肌重量的增加及心肌纖維化的程度呈正相關。干擾素γ和TNF-α可誘導心肌細胞表面產生細胞間黏附分子-1(ICAM-1),後者在心肌細胞和淋巴細胞的聯結中發揮作用。
(3)遺傳:擴張型心肌病的家族遺傳傾向不及肥厚型心肌病,但遺傳因素仍起一定作用,擴張型心肌病的家族連鎖比通常意識到的更為多見。有20%的病人其一級親屬也呈現擴張型心肌病的證據,提示家族遺傳相對常見。典型的家族性心肌病為神經肌肉病變,如Duchenne肌營養不良,與X性連鎖遺傳有關的Becker慢性進行性肌營養不良,二者均為抗肌萎縮蛋白基因(一種細胞骨架蛋白)突變所致。最近,在一患有與X性連鎖遺傳有關的心肌病但無骨骼肌病的家系中證實了與抗肌萎縮蛋白基因有關的心臟催化區域的缺失。有報道認為家族性心肌病存在線粒體異常,如Kearns-Sagre綜合征:心肌病、眼肌麻痹、視網膜病變以及小腦共濟失調。除肌蛋白和代謝異常外,遺傳因素還影響抗心肌免疫反應的觸發。有同一家族的成員在病毒感染后或妊娠時出現心力衰竭的報道。大多數家族性病例屬常染色體顯性遺傳,但該病在遺傳性上極具異質性,已報道有常染色體隱性遺傳49及X-連鎖遺傳者。有一種類型的家族性X-連鎖擴張型心肌病系基因的啟動子區和編碼肌營養不良蛋白(dystrophin)的第一外顯子缺失所致,后一種蛋白是構成肌細胞骨架的成分之一。據此推測,由上述基因變化所造成的心臟肌營養不良蛋白缺乏乃是擴張型心肌病的病因。此外,也有報道線粒體DNA發生突變者。至於無明顯家族連鎖的病人是否都具有擴張型心肌病的遺傳易感性則仍屬不明。目前已發現多個與家族性心肌病顯性遺傳相關的染色體位點,包括1號染色體(q32,p1-q1),2號染色體(q31),5號染色體(q33-34),6號染色體(q12-16),9號染色體(q13-22),14號染色體(q11),15號染色體(q14,q22),並且發現伴有二尖瓣脫垂的DCM患者的顯性位點位於10號染色體(q21-23)。
2.病理及病理生理DCM的心臟擴大常兩倍於正常人,且均有一定程度的心肌肥厚,心臟擴張為普遍性,即各房室腔均擴張,二尖瓣和三尖瓣瓣環增大,偶爾有瓣葉邊緣增厚,因心肌及心內膜都有纖維化,故心臟外觀呈蒼白色,心腔內有附壁血栓。光鏡下,心肌纖維常明顯變粗、變性、壞死及纖維化。電鏡下,心肌細胞內肌原纖維含量減少,線粒體增大,增多,嵴斷裂或消失,肌漿網擴張,糖原增多。組織化學檢查,琥珀酸脫氫酶、膦酸酯酶和糖原不同程度減少,鈣依賴性ATP酶、馬來酸脫氫酶、谷氨酸脫氫酶和5-核苷酸酶減少,LDH和LDH5升高,可能與血流動力學失代償有關。DCM病人因心肌病變,使心臟收縮功能障礙,心排血量減少,心臟殘餘血量增多,左室舒張末壓升高,心腔被動擴張,肺循環與體循環淤血,產生頑固性心力衰竭的表現。由於心腔極度擴張,房室瓣環周徑增大引起房室瓣關閉不全併產生相應的收縮期雜音。歷久,左心房、肺動脈壓力相繼升高,最後出現右心衰,心室腔擴大,心壁內張力增加,氧耗增多,心肌肥厚,心率加速導致心肌相對缺血,而心肌攝取氧的能力已達極限,因而可發生心絞痛。心肌病變累及起搏和傳導系統時可引起各種心律失常。DCM發展到充血性心力衰竭階段,神經內分泌過度激活,包括交感神經系統(SNS)、腎素-血管緊張素系統(RAS)和加壓素,從而促進心衰惡化,內源性心房肽亦有激活,但不足以抵消SNS和RAS的作用。在DCM初始的心肌損害,循環內分泌迅速激活,但當心血管取得代償,循環內分泌即恢復正常或僅有輕度升高,但這一代償是犧牲有效局部血流為代價得來的,直至最後即進入失代償期,循環內分泌又重新激活,很多亞臨床的病理生理過程包括心血管重塑正在進行,而心肌組織的自分泌和旁分泌則起重要作用。因此,Packar認為神經內分泌系統的激活是導致心力衰竭進行性加重的原因。
診斷:根據臨床表現、輔助檢查,並排除其他常見的心臟病如風濕性、冠狀動脈粥樣硬化性、先天性、高血壓性或肺源性心臟病以及心包疾病或急性心肌炎后,方可診斷本病。可參考以下診斷標準:
①起病多緩慢,以充血性心力衰竭為主要表現;
②心界擴大,奔馬律,可出現各種心律失常;
③X線檢查示心影擴大;
④心電圖示心臟肥大,心肌損害,心律失常;
⑤超聲心動圖示心室內徑擴大,室壁運動減弱,左室射血分數降至50%以下;
⑥排除其他心臟病。
實驗室檢查:
1.血清學檢查可有紅細胞沉降率增加、球蛋白異常,偶有心肌酶活性增強。考慮到DCM可由心肌炎演變而來。
2.抗心肌抗體和病毒檢測非常必要,可能檢測出多種抗心肌自身抗體;病毒滴度的連續測定有助於病毒性心肌炎的診斷。
3.外周血嗜酸性粒細胞增加時應進一步檢查有無系統性變態反應性疾病存在,因為這些疾病可引起過敏性心肌炎。
其他輔助檢查:
1.心電圖常顯示左心房和(或)左心室增大,但R波異常增高較少見;可有QRS波低電壓,多見RV6>RV5;胸前導聯常可見病理性Q波,許多患者可出現非特異性QRS波增寬;約1/4病人可有房顫,約20%的患者可出現左束支傳導阻滯;除Chagas病外右束支傳導阻滯較少見。P-R間期延長亦相當常見,且與某些患者存活時間的縮短有關。嚴重的傳導阻滯提示可能是巨細胞性心肌炎或結節病。非特異性ST段壓低及T波改變常見。
2.胸部X線檢查心影多增大,但有些患者在心影增大之前左心室已明顯向後增大。由於胸片反映右心室擴大的敏感性要較左心室擴大為高,而右心衰竭常提示預后不良,所以胸片對預后判斷有一定意義。肺靜脈高壓時可有KerleyB線。有心包積液時透視下可見心臟搏動減弱。
3.超聲心動圖可確定有無左、右心室擴大和心肌收縮力降低,並有助於同其他類型的心肌病以及瓣膜病、先心病等進行鑒別。其特徵性改變為左、右心室腔增大及左室後壁運動減弱,室間隔可呈矛盾運動,室間隔和心室遊離壁的厚度變薄,但亦可正常,短軸縮短率明顯減低,可見功能性二尖瓣反流。繼發於DCM的功能性二尖瓣反流通常無瓣膜或腱索的異常改變,而DCM時瀰漫性室壁運動減弱亦不同於冠心病時局部室壁運動障礙。
4.心導管檢查在大多數伴心臟擴大的心衰患者中,為排除冠狀動脈粥樣硬化或畸形而行冠狀動脈造影時需慎重考慮。當存在心衰失代償性血流動力學改變時,右心導管測定心排出量和心室充盈壓有助於臨床判斷並指導治療。
5.心內膜心肌活檢心內膜心肌活檢的絕對指征是心臟移植排異反應及蒽環類抗生素心肌毒性反應的監測。
以下2組擴張型心肌病可考慮行心肌活檢:
①癥狀出現在3個月或6個月以內;
②原因不明的心肌疾病。以淋巴細胞浸潤為組織學表現的在第1組患者中陽性率為5%~20%,第2組患者中不足10%。由於上述組織學改變的意義尚不確知,有據此確診的,亦有得出其他診斷的。在決定對患者行心內膜心肌活檢時,必須考慮到明確診斷對治療或預后判斷的意義有多大。隨著新的生物化學技術替代現有的染色以及顯微鏡的進一步發展,心肌活檢的應用將更加廣泛。
DCM缺乏特異性的診斷指標,診斷的確立常採取排除其他器質性心臟病,且需與以下幾種心臟病鑒別。
1.風濕性心瓣膜病DCM可有二尖瓣或三尖瓣關閉不全的雜音及左房擴大,易與風濕性心臟病混淆。前者心臟雜音在心力衰竭時較響,心衰控制后,雜音減輕或消失,而後者在心衰控制后,雜音反而明顯,且常伴二尖瓣狹窄和(或)主動脈瓣雜音,在連續聽診隨訪中有助於鑒別診斷。超聲心動圖可顯示瓣膜有明顯病理性改變,而心肌病則無,但可見房室環明顯擴張。
2.心包積液大量心包積液時,心臟外形擴大,和普遍心臟增大型的DCM相似。DCM的心尖搏動向左下移位,與心濁音外緣相符,常可聞及二尖瓣或三尖瓣關閉不全的收縮期雜音。心包積液時左心外緣叩診為實音,心尖搏動消失,心音遙遠,且在左緣實音界的內側聽到。超聲心動圖可清晰見到心包積液區及判斷積液量多少,做出明確診斷。DCM在心衰時即使出現心包積液,其量甚少,並具大心腔二尖瓣小開口的特徵。
3.冠心病少數嚴重冠心病患者,心肌有多發性小梗死灶或因慢性缺血形成廣泛的纖維化,心臟各腔室都擴大,有時難與DCM相鑒別,下列幾點有助於鑒別診斷:
①DCM患者年齡較輕,無心絞痛的典型癥狀;
②冠心病患者心電圖多有與冠狀動脈供血部位相一致的異常Q波及ST-T改變,而DCM的ST-T改變廣泛,即使出現Q波也多不典型,且與冠狀動脈供血分佈無相應關係;
③超聲心動圖,冠心病多以左室受累為主,壞死的心肌無收縮功能或出現相反搏動,呈節段性分佈。DCM則各房室均見擴大,心肌運動普遍減弱;
④選擇性冠狀動脈造影,可排除或肯定冠心病的診斷;⑤心肌核素檢查。
4.心肌炎病毒性或風濕性心肌炎在少數嚴重病例中可有明顯的心臟擴大、奔馬律、收縮期雜音等,與DCM酷似。一般而言,這種嚴重的心肌炎多屬於急性期,但也可以延至數周至2、3個月,而DCM多屬於慢性。詳細詢問有無上呼吸道感染病史,病毒血清試驗有一定幫助,判斷風濕活動的一些血清學檢查可以提供一些依據。
由於本病原因未明,除心臟移植術外,尚無徹底的治療方法。治療目標是有效控制心力衰竭和心律失常,緩解免疫介導的心肌損害,提高病人的生活質量和生存率。
1.心力衰竭的治療限制體力活動,低鹽飲食,多數病人可用洋地黃製劑,但易發生洋地黃中毒,用量宜小,地高辛常用量為0.125mg/d。根據患者的血流動力學狀態可酌情使用利尿葯和血管擴張葯。幾乎所有病人均可使用血管緊張素轉換酶抑製藥(ACEI),ACEI不僅能改善心力衰竭的血流動力學異常,還能阻斷心力衰竭時神經內分泌系統的異常激活,抑制心肌重塑,從而改善預后。近年來ACEI類藥物進展很快,常用藥有卡托普利12.5~25mg/d,依那普利2.5~10mg/d。
2.心肌保護
(1)β-受體阻滯葯:DCM患者血清抗β1-腎上腺能受體抗體具有β受體激動劑樣活性,抗β1-受體抗體可能通過受體門控途徑,引起細胞內鈣超負荷,導致心肌細胞損害,而β受體阻滯葯可阻斷上述效應。此外,β受體阻滯葯可顯著降低DCM患者血清TNFα、IL-10和sTNFR水平,提示β受體阻滯葯具有免疫調節作用。長期應用β受體阻滯葯治療擴張型心肌病可以預防患者病情惡化、改善臨床癥狀和左心室功能,減少死亡,改善預后。由於DCM患者血清中存在抗β1受體抗體,其介導的心肌損害發生在疾病的早期,因此對於早期DCM患者應用β受體阻滯葯將會得到更好的療效。常用藥物有美托洛爾、比索洛爾、卡維地洛等,應用時應從小劑量開始,無不良反應再逐漸加大劑量,如美托洛爾6.25mg,2次/d,逐漸增加至12.5~50mg,2次/d;比索洛爾1.25mg/d,逐漸增加至5~10mg/d;卡維地洛起始量為3.125mg,2次/d,逐漸增加至25~50mg,2次/d。
(2)鈣拮抗藥:DCM患者血清中存在的抗ADP/ATP載體抗體通過增加心肌細胞膜鈣電流和胞漿遊離鈣濃度,引起心肌細胞損傷,應用鈣拮抗藥可以防止該效應的發生。1996年Figulla等報道地爾硫治療擴張型心肌病多中心試驗(DiltiazeminDilatedCardiomyopathy,DiDi)的結果,顯示在心力衰竭治療的基礎上加用地爾硫治療能明顯改善擴張型心肌病患者的心臟指數和運動耐量。地爾硫DCM干預研究(InterventionStudyofDiltiazeminDilatedCardiomyopathy,ISDDC)顯示地爾硫能改善早期DCM患者左室舒張末期內徑和射血分數,顯著改善心功能。預後分析顯示,因心衰加重需要住院治療者減少,死亡率降低。ISDDC試驗證明,地爾硫治療DCM安全有效,適合於DCM的早期治療,其主要藥理機制被認為是干預抗體免疫介導的心肌損害,保護心肌。晚近,臨床隨機雙盲PRAISE試驗提示新的鈣拮抗藥氨氯地平(amlodipine)能延長DCM患者的存活率,對嚴重心衰患者不增加心血管發病率和病死率。動物實驗顯示氨氯地平可引起劑量依賴性氮化物產生的增加,同時也增加大冠狀動脈和主動脈內氮化物的產生,後者反映一氧化氮(NO)的合成增加;局部血管釋放NO可使血管擴張。亦有學者認為氨氯地賓士療心衰的機制可能是由於該葯能降低IL-6等細胞因子所致,尤其適於DCM早期治療。
(3)免疫吸附療法:由於約70%DCM患者血清中可檢出抗β1受體抗體,體外研究顯示該抗體可介導β1受體的慢性刺激,導致心肌持續損害和病情進展。國外報道,應用免疫球蛋白吸附法清除DCM患者血液中IgG、IgM、IgA、IgE和抗β1受體抗體,同時進行糾正心衰的基本治療,經過1年隨訪,DCM患者左心室射血分數、左心室舒張期末內徑和心功能均得到明顯改善。
(4)免疫球蛋白:免疫球蛋白通過調節炎症因子與抗炎因子之間的平衡,產生良好的抗炎效應,改善患者心功能。有研究表明,給新近診斷的擴張型心肌病(出現癥狀時間在6個月內)靜脈注射免疫球蛋白2g/kg,6個月和12個月後LVEF增加。
3.防止血栓形成和栓塞併發症對於合併房顫的患者,除有禁忌證外,可考慮加用抗凝劑或小劑量溶栓劑(如尿激酶、鏈激酶、阿替普酶等)治療。華法林、阿司匹林、噻氯匹定(抵克立得)、低分子肝素含化片等長期應用有防止血栓形成的作用。房顫病人如需行電復律必須行食管超聲檢查,在排除心臟內血栓或者有效抗凝治療至少4周后,才能進行電復律。
5.中藥黃芪具有免疫調節作用,可用於本病治療。
6.其他
(1)甲狀腺素:有研究報道,成人DCM患者大多伴有亞臨床型甲狀腺病變,經用甲狀腺粉(100μg/d)后,可見左室射血分數增加,左室心肌變力效應得以改善,靜息狀態外周阻力降低和心排出量增加。甲狀腺粉還可增加β受體密度,從而改善DCM患者伴隨的β受體下調。目前,甲狀腺粉尚處於臨床試用階段,需進一步研究及臨床驗證。
(2)生長激素:生長激素(GH)不僅參與人體生長的調節過程,而且還可參與心臟的發育和心肌增厚的調節。GH缺乏可減少左室心肌重量、減低左室射血分數;慢性GH缺乏可引起擴張型心肌病,甚至出現心力衰竭。研究顯示DCM患者左室心肌重量改變與血漿IGF濃度改變相關。基於GH用於GH缺乏患者能增加左室心肌重量,改善心功能,提示GH可用於DCM的治療。GH用於治療DCM目前亦處於臨床試用階段,療效有待觀察。
7.介入治療
(1)雙心室同步起搏:近幾年,雙心室同步起搏用於頑固性心力衰竭的治療已取得令人振奮的結果。雖然雙心室同步起搏對心力衰竭原發病因及心肌病變不起作用(如心肌缺血及心肌勞損),但可糾正心功能異常。雙心室同步起搏可恢復雙心室電及機械活動的同步化,使QRS波明顯變窄,心室間機械延遲縮短,心室充盈時間明顯增加,減少二尖瓣反流,使Ⅲ級~Ⅳ級心力衰竭患者的心功能得到不同程度的改善,心臟縮小,從而達到改善預后,延長生存時間的目的。
(2)心臟自動轉復-除顫器(AICD):對從心臟停搏恢復的所有病人、伴有反覆性室性心動過速引起休克或心衰惡化,而且不能被抗心律失常藥物治療控制的病人,皆應植入AICD。對伴頑固性陣發性室性心動過速、心室顫動的DCM患者安置AICD能自動中止突發的室性心動過速和心室顫動,明顯延長患者壽命,但不能終止病情的發展。
(3)射頻消融:對伴慢性心房撲動的患者,主張施行射頻消融術。臨床研究發現,隨著心房撲動的消失,心臟功能可得到明顯改善。
8.外科治療進展
(1)左室減容手術:左室減容手術由Batista等首先報道,他們將DCM患者擴大的左心室遊離壁縱向部分切除。結果發現術後患者左室容積減小,心功能得以改善。左室減容術基於DCM患者左室擴大、鬆弛,而減容手術后左室腔減小,更趨於橢圓形,左室壁局部應力減小,心室肌僵硬度減低,減少左室后負荷(如收縮期室壁應力),進一步減少心室耗氧量,改善左室泵功能。
(2)動態心肌成形術:1993年由Carpentier等首先報道,將擴張型心肌病患者左側背闊肌分離、包裹擴大的心臟,術后2周開始用直流電刺激背闊肌,以增加左心室的收縮力。作者總結7年中52例接受心肌成形術的心衰患者,結果顯示術前病死率23%(12/52),術后病死率20%(8/40),術后實際7年存活率70.4%。隨訪中發現患者心功能改善,LVEF提高。心導管顯示肺動脈壓、肺毛細血管楔嵌壓和左室壓無明顯改變。當心臟移植禁忌時,此法可作為替代方法之一。該手術改善心功能的作用機制在於:①骨骼肌包繞心臟,起到纏繞效應,從而停止衰竭心肌的重構;②骨骼肌的主動收縮,輔助增強了衰竭心臟的收縮力。
(3)左心輔助裝置(LVAD):Cooley等首先提出臨時機械循環支持用於等待心臟移植的晚期心衰患者的過渡時期。目前報道的左心輔助裝置(LVAD)主要有TCI和Navaco兩種可埋藏式LVAD。LVAD包括體內安置的驅動器、體外控制部和電池盒。驅動部安置在腹腔,經流入管、流出管穿過膈肌分別連接升主動脈近端和左室心尖部。經皮導線連接驅動部和控制部及電池盒。驅動部內安置方向相反的2個驅動片、1個生物瓣(豬心包)和能量轉換器,可將左心室血液直接泵入升主動脈。體外控制部和電池盒可掛於皮帶上或置於挎包中,便於攜帶。LVAD能提供最大搏出量70ml,泵排出量10L/min。Frazier等報道多中心臨床試驗,34例等待心臟移植的晚期心衰患者應用LVAD后,肝、腎功能明顯改善,心功能改善,LVAD使用時間甚至超過300天;65%患者得以接受心臟移植。安置LVAD有發生以下併發症的可能:出血、感染、右心衰竭、溶血、周圍器官功能失調和血栓栓塞等。雖然如此,LVAD仍不失為等待心臟移植過渡時期的一種治療方法。
(4)心臟移植:1967年Barnard首次完成同種異位心臟移植術后,30多年來心臟移植已從試驗階段過渡到臨床應用階段,目前在國際上應用漸廣。Hosenpud等報道國際心臟移植登記(包括301個心臟移植中心)從1982年至1998年3月,全世界共進行心臟移植45993例,1年存活率97%,5年存活率約65%,半數死亡時間8.7年,每年病死率約4%。隨著時間的推移,技術發展,存活率隨之提高。半數死亡時間1980~1985年為5.3年、1986~1990年為8.8年,1991~1997年為9.4年。目前心臟移植技術日臻成熟,能提高患者存活率,改善心功能,提高生活質量。是晚期DCM患者有效治療方法之一。心臟移植存在以下問題:①供體缺乏;②費用昂貴;③術后感染;④術後排斥反應。我國心臟移植起步較晚,發展相對緩慢。1978年上海瑞金醫院首例心臟移植患者存活109天。1992年北京安貞醫院、牡丹江心血管醫院、哈爾濱醫科大學二附院先後成功報道心臟移植,目前存活者已有超過5年者。1993年北京阜外心血管病醫院報道心肺移植。至今我國心臟移植例數有限,與國際水平相比,存在明顯差距。
(5)自體骨骼肌衛星細胞移植術:是一種近年來發展起來的用於治療擴張型心肌病、心肌梗死等疾病的新型手術方法。其基本原理是用具有多分化能力的骨骼肌幹細胞通過移植的方法,來代替功能低下或沒有功能的心肌。移植細胞在心肌內分化、成熟為類似於心肌細胞收縮、結構、電生理特性的橫紋肌細胞,並具有增強心功能效應。該方法處於實驗研究階段,其臨床效果,尤其是遠期療效還未見報道。
本病常發生心力衰竭、心律失常、心臟性猝死及栓塞等併發症。
1.心力衰竭擴張型心肌病患者由於心肌病變、心臟擴大、左心室擴張或雙心室擴張,引起左心室收縮功能障礙,出現收縮性心力衰竭。隨著病程進展,發生右心衰或全心衰。
2.心律失常該病易併發心律失常,多樣易變的心律失常及高發生率為其突出的特點。室早、房早和傳導阻滯(房室傳導阻滯和束支傳導阻滯)為最多見的心律失常、心動過速、心房顫動(20%)、心動過緩常見,嚴重者可發生室性心動過速,甚至室顫或停搏,可引起死亡。
3.心臟性猝死是擴張型心肌病最嚴重的併發症,也是擴張型心肌病主要死亡原因。心臟性猝死的發生率可多達30%以上。
預后:
擴張型心肌病的病程長短不一,發展較快者於1~2年死亡,較慢者可存活達20年之久,這主要取決於心臟擴大的程度、是否伴有嚴重的心律失常和難治性心力衰竭。文獻報道擴張型心肌病的自然史、病程及預后,受患者選擇、所用的診斷方法和標準、患者入選時的病期及隨訪時間等各種因素的影響,生存率或病死率不盡相同。許多研究的結果表明,擴張型心肌病的預后較差,病死率較高。根據文獻資料統計,擴張型心肌病的1年生存率58%~63%,5年生存率33%~40%,10年生存率20%;而1年病死率25%~58%,2年病死率30%~48%,5年病死率50%~80%,10年病死率達70%~92%。由於擴張型心肌病的自身影響因素很多以及治療條件的差異,尤其是本病的病因及發病因素尚未闡明,又無特異性的診斷指標,可以理解對生存率及病死率有很多不同報道。擴張型心肌病患者大多數死於頑固性心力衰竭,少數發生猝死,個別死於肺栓塞或其他原因。心力衰竭死亡者多見全心衰竭,左心衰竭次之,右心衰竭較少。猝死大都與惡性室性心律失常發作有關。一些研究結果表明,擴張型心肌病預後有改善的趨勢。DiLenarda等研究了從1978~1994年的235例擴張型心肌病的發病和死亡情況,每5年劃為一個研究階段,以死亡或接受心臟移植作為研究終點。結果發現2年生存率在1978~1982年做出診斷組(Ⅰ組,共26例)為73.8%;在1983~1987年組(Ⅱ組,共65例)87.7%,在1988~1992年組(Ⅲ組,共144例)為93.3%;4年生存率在三組分別為53.8%、72.3%及82.9%。由此看出,15年中擴張型心肌病發病例數逐漸增多,而死亡例數逐漸減少。作者分析認為,研究對象中年齡輕、早期得到診斷及近年應用ACEI、β受體阻滯葯者增多,是擴張型心肌病生存率增高的原因。
預防:
1.糾正病因及誘因如營養缺乏應予以糾正,與長期飲酒有關須戒酒,治療恢復后如再飲酒複發,則更難治療。圍生期心肌病應勸其避孕或絕育,以免複發。見於克山病流行區域者可給予硒鹽醫治。上呼吸道感染是擴張型心肌病誘發心功能不全的常見原因,特別是在易感染季節(冬春季),及時應用抗生素,酌情使用轉移因子、丙種球蛋白,以提高機體免疫力,預防呼吸道感染。
2.注意休息休息能減輕心臟負擔,促進心肌恢復。根據患者的心功能狀況,限制或避免體力和腦力勞動,以不發生癥狀為宜,但並不主張完全休息。有心力衰竭及心臟明顯擴大者,須卧床,予以較長時間的休息。
3.宣傳教育和照顧充分了解患者的癥狀,分析其病理生理改變以及心功能狀況。有充血性心力衰竭時,除了合理限制活動外,還應嚴格限制鈉鹽攝入。低鹽飲食的標準,一般控制食鹽在5g/d以下,病情嚴重者控制在1g/d以下。要向患者普及其所服藥物知識,了解患者的整體狀況,定期調整治療方案。據報道,有教育照顧組的病死率明顯低於無教育照顧組。
中國的資料:廣西南寧地區(1978)6個縣抽樣檢查66632例,年齡7~93歲。採用詢問病史、體格檢查篩選可疑者后,行X線和心電圖檢查,對檢查中疑有心肌病者行超聲檢查。
診斷標準為:
①有心臟增大表現;
②心力衰竭;
③心電圖有ST-T改變及無心肌梗死病史的異常Q波;
④嚴重心律失常;
⑤肺循環及體循環栓塞史。有以上1項者,排除其他器質性心臟病,即可診斷為原發性擴張型心肌病。結果顯示:確診為原發性擴張型心肌病共56例,患病率為84.0/10萬人。本研究採用橫切面的人群調查,因此,只能估計心肌病的患病情況。研究的結果存在著兩個明顯的缺點:
①僅對可疑者進行超聲檢查,不能發現早期、無癥狀病例;
②診斷標準中的心電圖改變、心律失常和栓塞史缺乏特異性。但由於是人群的基礎調查,年齡範圍大,因此,本研究的結果在文獻中廣為引用。南京市人群原發性擴張型心肌病的發病調查(1985~1989),根據市區14所醫院的臨床和超聲資料,按WHO(1980)的診斷標準和分類,5年內共發現60歲以下擴張型心肌病134例,年發病率為1.3/10萬人,年齡標化率為1.1/10萬人。此報道不能發現未來就診的無癥狀病例和散發在小醫院的病例。為了排除冠心病,僅分析60歲以下年齡的資料。因此,發病率顯然是低估了。另一方面,也不能排除60歲以下男性發生缺血性心臟病的可能。