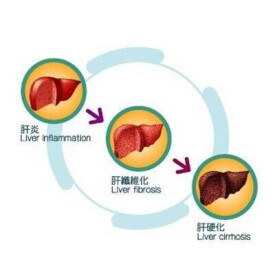
肝炎后肝硬化
肝炎后肝硬化
肝炎后肝硬化是指由於各同病因引起的肝臟慢性、進行性、瀰漫性病變,其特點是在肝細胞壞死的基礎上發生纖維化,並代之以纖維包繞的異常肝細胞結節(假小葉)。我國肝硬化的主要病因是病毒性肝炎,一般認為乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和丁型肝炎病毒的長期感染可引起肝硬化。
慢性乙型肝炎為何轉變為肝硬化
由於病人體內乙型肝炎病毒長期存在井進入肝細胞內,在肝細胞核內複製病毒的核酸部分,然後再在細胞漿中包上外殼.如此反覆整合的過程中,不斷刺激免疫系統,產生致敏淋巴細胞及相應的抗體.與抗體結合的致敏淋巴細胞和表面帶有乙型肝炎病毒的肝細胞相結合,使肝細胞破壞,病毒被消滅。在這個過程中.還產生纖維因子*使纖維母細胞合成膠原的作用增強,致使肝內纖維組織不斷地增生,久而久之,使肝臟發生纖維化.形成了肝硬化。
(一)病理分類
1.按病理形態分類:根據WHO制定的肝硬化形態學標準,按結節大小分為三型:①小結節性肝硬化:結節大小均勻,一般<3mm,纖維隔較規則,再生結節較少;②大結節性肝硬化:結節較粗大,大小不均,一般>3mm,最大可達數厘米,纖維隔不規則,再生結節多見;③混合性肝硬化:小結節和大結節兩種形態混合存在。
2.病理分型:按結節內所含腺泡功能單位主要分為三型:①單腺泡性肝硬化:至少75%的病變區是由單腺泡組成,其特徵是結節內不含有或只含有一個匯管區}②多腺泡性肝硬化:至少75%的病變區是由多腺泡功能單位組成的,結節內含有一個以上的匯管區;③混合腺泡性肝硬化:單腺泡性及多腺泡性硬化性結節至少各占病變區25%以上。
(二)病理髮生過程
肝臟在慢性炎性病變的刺激下成纖維細胞增生,可合成大量的膠原纖維,導致瀰漫性纖維增生及纖維束形成。肝小葉1帶碎屑狀壞死時,肝纖維化自匯管區向另一匯管區延伸'形成匯管區至另一匯管區的橋架纖維隔,稱為主動隔口肝小葉3帶肝細胞融合性壞死時,形成肝小葉中央至匯管區的橋架纖維隔,稱為被動隔。兩種纖維隔分別或同時包繞殘存肝小葉或再生結節,導致肝小葉結構性改建。結節外周完全被纖維隔包繞時,稱為完全性硬化性結節,不完全包繞者稱為不完全性硬化性結節,一旦出理硬化性結節,提示已進展至肝硬化。
(三)病理生理機制
2.門靜脈高壓:因肝小葉的結構破壞,纖維組織增生,門靜脈血液減少。同時,由於門靜脈與肝動脈分支之間直接交通,使門靜脈壓力升高。當門靜脈壓力超過300mmH2O(2.94kPa)時,可出現胃腸道瘀血、脾大、腹腔積液形成及門靜脈與腔靜脈的側支循環建立等臨床表現。在建立的側支循環中以食管靜脈曲張出現較早,其可能的原因有:①食管靜脈距門靜脈近,易受門脈高壓的影響;②食管靜脈位置甚淺,處於黏膜下層疏鬆結締組織中;③食管靜脈位於胸腔,吸氣時胸內負壓可使門靜脈血液更易流人。
1.甲型肝炎
一般發病急,病程持續時間較短,多在兒童和青少年中流行傳播。近幾年來,有向大齡組推移的趨勢。多在冬春季流行。病毒傳播方式主要是從口腔消化道進入肝臟。因其病程短,恢復快,一般不發展為慢性肝炎,故也不會轉變成肝硬化。
2.乙型肝炎
由乙型肝炎病毒傳播而引起。此種病毒可在病人體內長期存在,其中30%可發展成慢性肝炎,並可轉變成肝硬化。大多數病人從感染乙型肝炎病毒到出現肝硬化的臨床癥狀最短的5~10年,最長20~40年,它是轉變成肝硬化發病率最高的一種肝炎。
3.丙型肝炎
傳播方式、傳染途徑與乙型肝炎相似。目前認為:輸血后引起的肝炎中80%~90%屬丙型肝炎。此型肝炎也可轉變發展為肝硬化。
4.丁型肝炎
丁型肝炎病毒感染有兩種方式:
1)丁型肝炎病毒與乙型肝炎病毒同時感染(混合感染)。在急性的丁型肝炎病毒與乙型肝炎病毒同時感染的人群中,約有5%的病歷可發生慢性肝炎或轉變成肝硬化。
2)重疊感染了丁型肝炎病毒。慢性進行性丁型肝炎,既為慢性丁型肝炎惡化或無癥狀的乙型肝炎表面抗原陽性者,演變為進行性活動性肝炎。重疊感染發展為慢性肝炎者佔80%~90.9%,大部分轉變成肝硬化。
3).戊型肝炎
肝炎后肝硬化
5.皮膚表現
(2)肝病面容:是肝硬化患者比較特殊的臨床表現,面色呈灰暗、黝黑,甚者呈“古銅色”。
(3)蜘蛛痣和毛細血管擴張:直徑範圍為1~10mm,主要分佈於上腔靜脈引流的區域(面部、上肢、頸部、胸部及背部等),上腹部罕見。
(二)門靜脈高壓症
1.腹水形成:腹水的形成除與門靜脈高壓有關外,還有以下幾種因素:①低蛋白血症:當血漿白蛋白低於25~30g/L時,易出現腹水和肢體浮腫。同時,約5%~l0%的肝硬化出現腹腔積液的患者可合併胸腔積液,且以右側胸腔積液多見;②肝淋巴液失衡:肝淋巴液生成增多,每日可達7—11L(正常為1—3L),淋巴液自肝門淋巴管溢出至腹腔;③內分泌因素:抗利尿激素及繼發性醛固酮增多,增加對水、鈉的重吸收;④有效循環血容量不足:循環血容量不足可導致腎臟交感神經活動增強、前列腺素活性降低,循環血容量不足使致腎臟血流量、排鈉及排尿量減少。
(三)主要併發症
2.感染:肝硬化常見的嚴重感染為自發性腹膜炎及敗血症。感染可能與下列因素有關:①腸道菌群紊亂腸道菌叢紊亂、細菌過度生長及細菌移位;②門體靜脈分流使病原微生物可直接繞過肝臟進入體循環;③Kupffer細胞功能及巨噬細胞功能減退。
3.電解質平衡紊亂:以低鈉、低鉀、低氯血症為常見,當血鈉低於120mmol/L(多為稀釋性低鈉血症)時,可出現神經精神癥狀,預后極差。低鉀,低氯血症常可引起代謝性鹼中毒,是導致肝性腦病的常見誘因。此外,低鈣、低鎂血症亦較為常見。
4.肝性腦病
5.肝腎綜合征
6.肝細胞性肝癌:肝硬化患者若出現下列報警徵象時,應高度懷疑肝細胞性肝癌的可能:①不明原因的發熱(排除感染因索)者;②乏力、消瘦及體重進行性下降者;③肝區及右上腹疼痛進行性加重,經一般治療難以緩解者;④肝臟短期內進行性腫大者。
7.肝肺綜合征:肝硬化患者因肺部血流動力學的改變的出現肺功能異常稱為肝肺綜合征。約50%的肝硬化失代償性患者可見出現動脈氧分壓降低及肺通氣/灌流比失衡,表現為不同程度的低氧血症。臨床卜有杵狀指體征,但明顯的發紺或呼吸困難較為少見。肝硬化患者門一體靜脈分流術后,約有1%的患者出現肺動脈高壓,引起呼吸困難、暈厥、咯血、心前區痛及右心增生性肥大等臨床表現。
(一)肝炎后肝硬化的診斷
慢性肝炎診斷依據主要包括:①乙型肝炎病毒感染或乙肝表面抗原(HBsAg)陽性史超過6個月,現HBsAg和(或)HBV DNA仍為陽性者,可診斷為慢性HBV感染;②HCV感染超過6個月,或發病日期不明、無肝炎史,但肝臟組織病理學檢查符合慢性肝炎者,可診斷為慢性HCV感染。肝組織活檢病理做免疫組織化學法檢測,可顯示肝細胞中有無HBsAg和HbcAg的表達。HBsAg胞漿瀰漫型與胞膜型,以及HBcAg胞漿型與胞膜型表達,提示HBV複製活躍。HBsAg包涵體型與周邊型及HBcAg核型表達則提示肝細胞內存在HBV。
早期肝硬化診斷比較困難,許多病理組織學證實為肝硬化的患者,常可無任何癥狀或僅出現非特異性的消化道癥狀。代償性肝硬化的臨床診斷要點主要包括:①可有輕度乏力、食慾減少或腹脹癥狀,但無明顯肝功能不全表現;②肝臟儲備功能正常或基本正常,血清膽紅素<2mg/dl(35umol/L),血清白蛋白正常或偏低,但仍≥35g/L,凝血酶原活動度>60%;③可有門靜脈高壓症,如表現有輕度食管靜脈曲張,但無腹腔積液、上消化道出血及肝性腦病等。以下手段有助於肝硬化的早期診斷:①對病毒性肝炎患者必須嚴密隨訪觀察;②對原因不明的肝大,特別是肝質地堅實、表面不光滑者,有肝病面容者,出現蜘蛛痣、肝掌及毛細血管擴張等體征者,應採用包括超聲、腹腔鏡及肝組織活檢等檢查手段幫助確定性質。
肝硬化失代償期是指中、晚期肝硬化,一般肝功能屬Child-Pugh分級B與C級。主要臨床診斷要點包括:①有明顯肝功能不全表現;②肝臟儲備功能異常,血清白蛋白<35g/L,A/G<1.0,血清膽紅素>35umol/L,凝血酶原活動度<60%;③出現門靜脈高壓症,表現為脾大、腹腔積液及門靜脈高壓引起的食管胃底靜脈曲張或破裂出血等。
(二)炎症活動性和靜止性的診新
1.活動性肝硬化:血清酶活性升高,特別是ALT、AST升高,升高程度與炎症的活動性呈正相關。可伴有不同程度的黃疸。有些患者血清ALT、AST正常或輕度升高,但y-谷氨醯轉肽酶(y-GT)呈中度或明顯升高,在排除其他原因(如膽道疾病、膽汁淤積、肝癌等)后,提示慢性炎症活動性的持續存在。
(三)肝臟病理學診斷
肝臟病理組織活檢是早期診斷肝硬化的“金標準”,除具有肝硬化病理形態學的主要表現外,還必須同時具備瀰漫性肝纖維化、正常肝小葉結構被破壞和結節性改變的病理組織學改變。國內對慢性乙型肝炎患者肝組織炎症壞死的分級(G)、纖維化程度的分期(S),大多是參照2001年《病毒性肝炎防治方案》而指定的。目前國際上常採用Knodell HAI評分系統,亦可應用Ishak、Scheuer及Chevallier評分系統或半定量計分方案,了解肝臟炎症壞死及纖維化程度。
(四)肝炎后肝硬化的鑒別診斷
2.肝竇前性門脈高壓症:肝竇前性門脈高壓症的病因包括先天性肝纖維化、肝門靜脈硬化症、肝血吸蟲病及再生結節性增生等,患者的肝功能損害相對較輕,肝靜脈壓不高,可依據這些表現與肝炎后肝硬化門靜脈高壓症相鑒別。腹部超聲影像學及CT檢查對兩者的鑒別診斷有重要價值,最後確定診斷尚需進行肝活檢組織學檢查。
3.腹腔積液:肝硬化失代償期出現腹腔積液應與Buddi-Chiari綜合征、慢性肝小靜脈閉塞病及縮窄性心包炎等循環障礙所致的腹腔積液相鑒別。
4.脾大:輕度大者需與慢性肝炎、特發性血小板減少性紫癜、慢性溶血性貧血、霍奇金病及慢性感染性疾病等相鑒別。脾臟中度大者需與慢性白血病、惡性淋巴瘤、慢性瘧疾、血液病(真性紅細胞增多症,地中海貧血)及骨髓纖維化等疾病相鑒別。
一)一般治療

肝炎后肝硬化
(二)藥物治療
1.抗病毒治療:肝炎病毒是導致慢性肝炎進展為肝硬化的重要因素,而且,肝炎病毒的致病作用貫穿於肝硬化的形成過程。國、內外不斷有報道提示,應用拉米夫定等抗病毒藥物治療活動性肝硬化及失代償期肝硬化,可延長患者的生存期,提高生存質量,降低病死率。抗病毒藥物包括拉米夫定,阿德福韋酯、恩替卡韋及干擾索等。
慢性乙肝患者抗病毒治療的適應證包括:①HBV DNA≥105拷貝/mI(HBeAg陰性者為≥104拷貝/ml);②ALT≥2×ULN;若應用干擾素治療ALT應≤10×ULN,血總膽紅素水平應<2×ULN;③若ALT<2×ULN,但肝組織學顯示Knodell HAI≥4,或≥G2炎症壞死。具有①並有②或③的患者應進行抗病毒治療。
在肝硬化患者應用抗病毒藥物治療中應注意的幾個問題:①肝硬化患者必須有明確的病毒活躍複製指標,包括HBeAg、HBV-DNA陽性或HCV-RNA陽性。不少肝硬化患者的病毒複製指標不明顯,不宜採用抗病毒治療。②肝硬化早期應用抗病毒治療效果較好。③抗病毒治療的同時應注意對肝硬化患者的綜合治療,特別是對肝硬化失代償期的患者,可補充血漿及白蛋白等,有感染跡象的肝硬化患者需加用抗生素,以減少內毒素血症對肝臟的影響。④不可選用干擾素治療肝硬化失代償期患者,否則會加重病情,儘管國外有報道用干擾素治療者,但國內專家大多都不予主張。⑤可選用氧化苦參鹼等治療,這些藥物作用相對溫和,患者用藥的依從性好,併兼有部分抗纖維化作用。
(三)腹腔積液的處理
在肝硬化患者中慢性低鈉血症很常見,過快的糾正低鈉血症會導致更嚴重的併發症。因此,只有當血鈉<120—125mmol/L時,才需要補充高張鈉鹽。
口服利尿劑一般選用螺內酯與呋塞米同時服用,初始劑量為口服螺內酯100mg、呋塞米40mg,每日早晨頓服。每3~5天可同時調整兩種利尿葯的劑量(保持螺內酯與呋塞米的比例為5:2),最大劑量為螺內酯400mg/d、呋塞米160mg/d。單次大量放腹腔積液,隨後給予限鈉和利尿劑治療是緩解張力性腹腔積液的有效方法。單次放腹腔積液5L是安全的,在放腹腔積液后宜同時輸注人血白蛋白(每放腹腔積液1L,補充人血白蛋白8g)。若患者對利尿劑敏感,應在放腹腔積液後繼續應用利尿劑並限鈉飲食,一般不主張將多次反覆放腹腔積液作為一線治療。
為了預防肝硬化患者消化道出血的癥狀,在肝硬化的飲食中會安排一些比較柔軟的飲食,如粥。有時還會在粥中加入一些中藥材,就是所謂的葯粥,進行肝硬化的飲食調理。應用葯粥療法治療疾病,在我國有數千年的歷史。粥是中國傳統而頗有特色的一種食物形式。這一肝硬化飲食具有經濟、簡便、安全、有效的特點。在肝硬化飲食上的葯粥的配製方式有多種。可以將具有藥效作用的食物(如大棗、龍眼、赤小豆等)與粳米等同煮為粥;也可以將中藥先研為細粉(如芡實、人蔘、藕粉等),再與粳米等一起煮粥;或者先將中藥(如黃芪、當歸、首烏、熟地等)煎取葯汁,待米粥煮成后兌入服用或以葯汁與粳米等一起煮粥;如果是新鮮中藥(如紫蘇、藿香、荷葉等)可以直接或取汁與粳米等煮粥。